Der folgende Text ist die Übersetzung eines Artikels von Dr. Allison Siebecker und Dr. Steven Sandberg-Lewis, „SIBO: Dysbiosis Has A New Name„, der in der Februar/März 2015 Ausgabe des „Townsend Letter„, einem alternativmedizinischen Magazin in Amerika, abgedruckt wurde. Er ist die überarbeitete und erweiterte Fassung eines Artikels der schon 2013 im gleichen Blatt erschien, „Small Intestine Bacterial Overgrowth: Often-Ignored Cause of Irritable Bowel Syndrome“ („Dünndarmfehlbesiedlung: Oft ignorierte Ursache des Reizdarmsyndroms“ – der wird von mir nicht separat übersetzt, weil er der veraltete Vorgänger von diesem Artikel ist). Für ein paar persönliche Infos und weiterführende Links zu den beiden Autoren siehe ganz unten, hinter der Bibliographie, da stehen zu den beiden ein paar Worte.
Da der Artikel sich in erster Linie an Ärzte richtet, ist er entsprechend fachlich geschrieben und da ich, wie andernorts schon erwähnt, nur angelesene und am eigenen Körper erlebte „Fachkenntnisse“ habe, ist es mir unmöglich, diesen Text in sich kurz und knapp zu erklären, ohne daß der Lesefluß völlig flöten geht – dafür verstehe ich manches selbst zu wenig im Detail und es läßt sich zwar mittlerweile sehr, sehr vieles im Internet finden, aber leider auch nicht immer alles. Ich werde relevante Abschnitte, im Laufe der Zeit, als einzelne Beiträge nochmal posten und dann meinen Senf dazu abgehen – Ernährung, Behandlung, Symptome und dergleichen, was für uns Betroffene halt wichtig ist und was meine eigenen Erfahrungen angeht.
Wer sich hierdurch zur Behandlung inspiriert fühlt: Bitte nur unter ärztlicher Aufsicht oder auf eigene Verantwortung – ich mache folgende Informationen nur deutschsprachig zugängig und übernehme keinerlei Haftung für was auch immer wer auch immer mit diesen Informationen anstellt!!
⭐
DDFB: Dysbiose hat einen neuen Namen
von Steven Sandberg-Lewis, ND, DHANP und Allison Siebecker, ND, MSOM
Erschienen im „Townsend Letter“, Februar/März 2015
http://www.townsendletter.com/FebMarch2015/sibo0215.html
Viele Patienten die aufgebläht sind, Schmerzen im Bauchraum, Verstopfung oder Durchfall haben, werden mit dem Reizdarmsyndrom (RDS) diagnostiziert und springen aber auf dessen Behandlungen einfach nicht an. Andere bekommen überhaupt keine Diagnose für all ihr Leiden, was zu noch weniger Chancen auf Heilung führt. Wir haben die Erfahrung gemacht, daß viele dieser die Ärzte vor Rätsel stellenden Patienten eine mikrobielle Fehlbesiedlung von Kommensalen haben. Dieser Artikel stellt detailliert die komplexe Angelegenheit einer Dünndarmfehlbesiedlung (DDFB) vor.
Eine bakterielle Fehlbesiedlung des Dünndarms (DDFB) ist ein Zustand, in dem unnatürlich hohe Zahlen an kommensal lebenden Bakterien im Dünndarm vorkommen. DDFB ist eine häufige Ursache für RDS – tatsächlich liegt es bei über der Hälfte aller RDS-Fälle vor und, in einer Studie, in der Atemtests zur Diagnose verwendet werden, bei bis zu 84%.2 Es ist verantwortlich für 37% an Fällen, in denen endoskopische Kulturen aerobischer Bakterien zur Diagnose verwendet werden. 3 Eradikation dieser Fehlbesiedlung führt zu einer Linderung der RDS-Syndrome um 75%.4 Es ist entweder eine bakterielle Fehlbesiedlung oder eine Fehlbesiedlung methanogener Archaeen, die zur Beeinträchtigung von Verdauung und Absorption führt sowie der Produktion überschüssiger Mengen an Wasserstoff, Wasserstoffsulfid (Schwefelwasserstoff) oder Methan. Wasserstoff und Methan werden nicht von menschlichen Zellen hergestellt, sondern sind das metabolische Produkt der Kohlenhydrat-Vergärung durch Darmorganismen. Wenn Kommensale (orale, Dünndarm- oder Dickdarmflora) sich zahlreich im Dünndarm vermehren, ist eine DDFB wahrscheinlich. Wasserstoff-/Methan-Atemtests sind die am meisten verbreitete Methode zur Feststellung dieser Fehlbesiedlung. Stuhlproben sind zur DDFB-Diagnose nutzlos.
Symptome einer DDFB beinhalten:
– Aufblähen/Aufgeblähter Bauchraum (Meteorismus)
– Blähungen, Aufstoßen
– Schmerzen im Bauchraum, Unwohlsein oder Krämpfe
– Verstopfung, Durchfall oder eine Mischung aus beidem
– Sodbrennen
– Übelkeit
– Malabsorption: Steatorrhoe (Fettstuhl), Eisen-, Vitamin D-, Vitamin K- oder Vitamin B12-Mangel, mit oder ohne Anämie, und Osteoperose5
– Systemische Symptome: Kopfschmerzen, Müdigkeit, Gelenk- und/oder Muskelschmerzen und bestimmte Hautprobleme
Andere, mit DDFB in Verbindung gebrachte Krankheiten sind, unter anderem: Schilddrüsenunterfunktion, Laktoseintoleranz, Gallensteine, Morbus Crohn, Sklerodermie, Zöliakie, chronische Bauchspeicheldrüsenentzündung, Divertikulitis, Diabetes mit autonomer Neuropathie, Fibromyalgie und chronische, lokale Schmerzsyndrome, hepatische Enzephalopathie, nicht-alkoholbasierte Fettleber, interstitielle Zystitis, Restless-Legs-Syndrom, Rosacea (ehemals Akne Rosacea) und Refluxösophagitis.6-21 Auf klinischen Erfahrungen basierend, vermuten wir, daß biliäre Dyskinesie und lymphozytäre Colitis ebenfalls mit DDFB assoziiert sein können.
Bei der Arbeit in unseren Praxen haben wir festgestellt, daß folgende Indikatoren die Wahrscheinlichkeit erhöhen, daß das RDS eines Patienten durch eine DDFB verursacht wird:
– Wenn ein Patient RDS nach einem akuten Fall Gastroenteritis entwickelt (postinfektiöses RDS).
– Wenn Patienten eine erhebliche, aber nur vorübergehende Verbesserung ihres RDS nach der Einnahme von Antibiotika vermelden.
– Wenn ein Patient, nach der Einnahme probiotischer Supplemente, die ebenfalls Prebiotika enthalten, von Verschlimmerung der RDS-Symptome berichtet.
– Wenn ein Patient berichtet, daß der Verzehr von Ballaststoffen die Verstopfung und andere RDS-Symptome verschlimmert.
– Wenn ein Zöliakie-Patient von unzureichenden Verbesserungen der Verdauungssymptome berichtet, obwohl er sich glutenfrei ernährt.
– Wenn ein Patient den Typ RDS mit Verstopfung (IBS-C) entwickelt, nachdem er Opiate eingenommen hat.
– Wenn ein Patient chronisch niedrige Eisenwerte hat, ohne weiteren ersichtlichen Grund.
– Wenn radiologische Abbildung des Bauchraums eine große Luftansammlung sichtbar macht, durch die die Bauchspeicheldrüse verdeckt wird.
– Wenn die Dünndarmpassageuntersuchung „Flockenbildung“ aufzeigt.22
Mechanismen durch die Fehlbesiedlung verhindert werden
Ein wichtiger Schutzmechanismus gegen DDFB ist eine einwandfreie Dünndarm-Motilität durch den migrierenden motorischen Komplex, denn die Stauung fördert bakterielles Wachstum. 23 Schlüsselfunktionen in der Vermeidung tragen auch Magen-, Bauchspeicheldrüsen- und Gallenblasen-Sekrete, da Salzsäure, Enzyme und Galle bakterizid/statisch sind. 24 Konditionen, die den Glykokalyx und die Mikrovillus-Bereiche des Bürstensaums stören, können Fehlbesiedlung antreiben. Die darin involvierte Pathophysiologie ist der Verlust der Disaccharidase in diesen Gebieten, was zur Kohlenhydrat-Malabsorption führt, die wiederum überschüssiges Substrat für mikrobielles Wachstum zur Verfügung stellt. Die Rolle einer ordnungsgemäßen Funktion der Ileozäkalklappe mag ebenfalls wichtig sein, um zäkoilealen Rückfluß in den Dünndarm zu verhindern.25, 26 Überraschenderweise hat eine kürzliche Studie suggeriert, daß die chirurgische Entfernung der Gallenblase das Risiko ebenfalls senken soll.27 Schleimhaut-Biofilme können präventiv wirken oder als Risiko.28, 29 Starkes Trinken, aber auch der moderate Alkoholkonsum hängt maßgeblich mit erhöhtem DDFB-Risiko zusammen.30 Der Gebrauch von Protonenpumpenhemmern fördert Fehlbesiedlung, vor allem jene der wasserstoffproduzierenden Arten. 31, 32
Definition
Bisher lag die Definition von DDFB in Kulturstudien bei ≥ 105 koloniebildenden Einheiten (KBE) pro ml proximaler Punktion des Jejunums. ≥ 103 KBE ist die jetzt vorgeschlagene Definition aufgrund aktuellerer Studien, die ergaben, daß ≤ 103 KBE die normale Keimzahl in gesunden Kontrollpersonen ist. 33, 34 Die Bakterien, die am häufigsten fehlsiedeln sind beides, kommensale Anaeroben – Bacteroides 39%, Lactobacillus 25%, Clostridium 20% – und kommensale Aeroben – Streptococcus 60%, Escherichia coli 36%, Staphylococcus 13%, Klebsiella 11%.35 Eine noch aktuellere Studie fand heraus, daß die Aeroben Escherichia coli 37%, Enterococcus spp 32%, Klebsiella pneumoniae 24% und Proteus mirabilis 6,5% sind. Es wird angenommen, daß die Wasserstoffproduktion im Dickdarm anti-entzündlich und geschwulstverhindernd wirkt, wohingegen Wasserstoff im Dünndarm die Symptome und Zeichen vom Reizdarm-Typus Durchfall (IBS-D) hervorruft.37 Zusätzlich zu den Bakterien, ist die Quelle von Methanproduktion bei DDFB das Archaeon Methanobrevibacter smithii. Dieser Organismus wurde mit Adipositas bei Menschen in Verbindung gebracht. 38 Ferner sind sulfatreduzierende Bakterien, wie Desulfovibrio Spezien, Anaerobe die Sulfat zu Schwefelwasserstoff reduzieren (H2S). Zusätzlich zu seiner Rolle bei DDFB, wird H2S als ein möglicher ätiologischer Faktor in Colitis ulcerosa und der Dickdarm-Karzinogenese erforscht.39 In normalen, niedrigen Mengen, hat H2S gastrointestinale Schutzfunktionen.40
Pathophysiologie von DDFB: Autoimmunität
Es hat sich herausgestellt, daß postinfektiöses RDS (PI-RDS) eine Autoimmun–Ätiologie in Mäuse- und Menschen-Studien darstellt (siehe Bild 1). Infektiöse Gastroenteritis ist der signifikanteste Umwelt-Risikofaktor für RDS.41 Organismen, die PI-RDS triggern sind, unter anderem, Campylobacter, Salmonella, Shigella, E. coli, Viren und Giardia.42-45
Bild 1
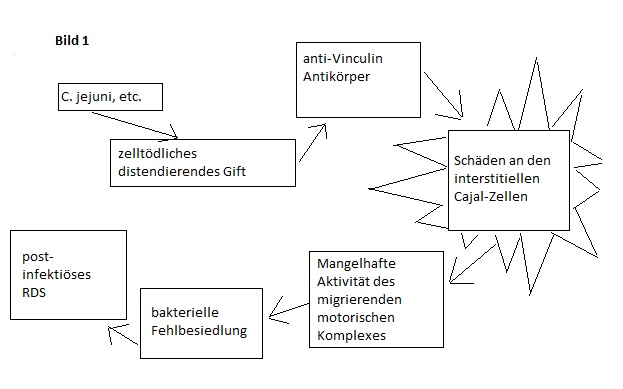
Zelltödliche distendierende Gifte (CDT) werden von enterischen Pathogenen gebildet, die PI-RDS verursachen. Campylobacter jejuni ist das prototypische Bakterium, das CDT produziert. 46 Andere CDT-produzierende Bakterien sind Haemophilus ducreyi (Ulcus molle/Weicher Schanker), Aggregatibacter actinomycetemcomitans (Paradontitis), Escherichia coli (Reisediarrhoe), Shigella dysenteriae (Dysenterie/Ruhr), Salmonella enterica (Typhus) und Campylobacter upsaliensis (Enterokolitis).
Die interstitiellen Cajal-Zellen (ICC) sind fibroblastenartige Zellen die als Schrittmacher für den migrierenden motorischen Komplex (MMC) fungieren. Es wird davon ausgegangen, daß eine Hauptursache für DDFB Unzulänglichkeiten am MMC sind, der, während der nächtlichen Nüchternphase und den Pausen zwischen den Mahlzeiten, Unrat und Bakterien in den Dickdarm befördert.47 Die Anzahl an ICC ist in post- Campylobacter jejuni Gastroenteritis infizierten Ratten reduziert, die schließlich DDFB entwickeln.48 Drei Monate nach C. jejuni-Gastroenteritis hatten 27% der Ratten DDFB. Diese Ratten hatten eine geringere ICC-Anzahl im Jejunum und Ileum als Kontrollratten (0,12 ICC pro Darmzotte war die Schwelle für DDFB-Entwicklung).
CDT-Gifte können die interstitiellen Cajal-Zellen zerstören, indem sie die Produktion von Autoantikörpern gegen ein Zellskelett-Protein namens Vinculin simulieren. Die Antigen-Antikörper-Komplexe zwischen Antivinculin-Antikörpern und zytolitischen distendierenden Giften führt zu einer autoimmunen Zerstörung von ICC.49, 50
Wie DDFB die Symptome des RDS erzeugt
Es sind zwei pathophysiologische Hauptaspekte bei DDFB involviert. Erstens: Bakterien können Kohlenhydrate fermentieren und andere Nährstoff konsumieren, die der Wirt zu sich genommen hat, einfach aufgrund ihres deplazierten Vorkommens im Dünndarm. Dies setzt sie verfrüht der Wirtsnahrung aus, bevor die Zeit zur Absorption reicht. Bakterielle Vergärung produziert Wasserstoff und/oder Wasserstoffsulfat. Zusätzlich produziert M. smithii Methan.51 M. smithii könnte in den Gedärmen von bis zu 95,7% aller Menschen vorkommen.52 Mikrobielle Gase führen zu den RDS-Symptomen des Aufblähens, Schmerzen, veränderter Stuhlgang, Aufstoßen und Flatulenzen.
Bild 2
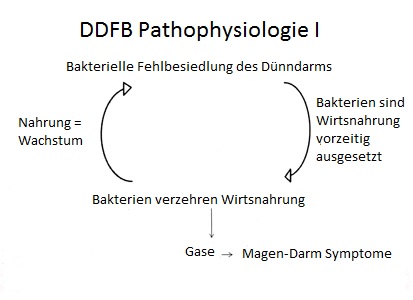
Quelle: Dr. Allison Siebecker
Die Menge an Gas kann beträchtlich sein, was ernsthaftes Aufblähen und Auftreibung/Überdehnung verursachen kann.53 Es wird geschätzt, daß mit der normalen Anzahl enterischer Flora die Lactose-Menge in 30 ml Milch die Produktion von 50 cm3 Gas verursacht. Mit mikrobieller Fehlbesiedlung kann die Gasproduktion der gleichen Menge Milch auf bis zu 5000 cm3 steigen.54 Überschüssiges Gas kann den Körper per Flatulenz oder Aufstoßen verlassen. Ein Teil wird auch ins Blut absorbiert, schließlich durch die Lungenbläschen gefiltert und ausgeatmet. Die Eingeweide sind druckempfindlich und daher kann der Druck des Aufgetriebenseins zu Schmerzen im Bauchraum führen. Ferner kann viszerale Überempfindlichkeit, ein Symptom des RDS, die Schwelle des Schmerzempfindens/Unwohlseins senken als auch eine Hyperreaktivität des muskulären Sichzusammenziehens als Reaktion auf das Gas hervorrufen, was zu Krämpfen führt.55, 56 Die Gase beeinflussen auch die Darmmotilität. Wasserstoff hat einen stärkeren Zusammenhang zu Durchfall, Methan steht fast ausschließlich mit Verstopfung in Zusammenhang.57, 58 Es zeigte sich, daß Methan die gastrointestinale Motilität bei Tierversuchen um 59% verlangsamt hat und das Volumen der Methan-Überproduktion korreliert mit dem Schweregrad der Verstopfung.59, 60 Wenn daher beides, Wasserstoff und Methan, präsent sind, können Durchfall, Verstopfung oder eine Mischung aus beidem vorhanden sein, basierend auf den jeweiligen Mengen dieser Gase.61 Es scheint, daß der von beiden Gasen entstehende Druck oder die herabgesetzte Magenmotilität zur Aufgetriebenheit des Magens führt, was wiederum zu einer gastroösophagealn Refluxkrankheit (GERD) führen kann.62 Der bakterielle Verzehr und deren Aufnahme der Wirts-Nährstoffe, wie B12 und Eisen, kann zu makrozytärer und/oder mikrozytärer Anämie oder chronisch niedrigen Eisenwerten führen, zusätzlich zu allgemeiner Malabsorption und Nährstoffmangel in ernsteren Fällen.63, 64 Die gesteigerte Motilität bei Durchfall kann ebenfalls Malabsorption herbeiführen. Letzten Endes wird, durch die kontinuierliche Fermentierung der Wirtsnahrung durch wiederholtes Ausgesetztsein der täglichen Mahlzeiten die bakterielle Fehlbesiedlung und RDS-Symptome endlos fortgesetzt, wodurch ein Teufelskreis entsteht (Bild 2).
Der zweite Mechanismus besteht aus mikrobiellem Schaden an der Verdauungs- und Absorptionsfunktion des Dünndarms. Anders als der Dickdarm, ist der Dünndarm nicht für starke bakterielle Kolonialisierung geschaffen. Kommensale Organismen können die Glykosidase künstlich erzeugen, was zu Schäden an der Glykokalyx und Disaccharidase führt. Die gastrointestinalen und systemischen Symptome, die durch diese Veränderungen herbeigeführt werden, sind in Bild 3 aufgezeigt. Schlüsselfaktoren sind bakterielle Dekonjugation von Gallensäure, was eine Fett-Malabsorption (Steatorrhoe) herbeiführt als auch einen Mangel an fettlöslichen Vitaminen; die bakterielle Verdauung von Disaccharidase-Enzymen, was die Kohlenhydrat-Malabsorption verschlimmert, vermehrte Vergärung und Gase hervorruft; eine gesteigerte Darmdurchlässigkeit („leaky gut“), die oft zu weiteren systemischen Symptomen führt.65-68
Bild 3

(Seite 2)
Diagnose der DDFB
Wie oben erwähnt, ist die Wasserstoff-Methantestung die häufigste Methode um DDFB festzustellen. Die nötigen Gerätschaften sind bei der Firma Quintron Instrument Company in Milwaukee, Wisconsin erhältlich. Sie bieten ein Gerät namens „Breathtracker“ an, welches zur Messung der Gase verwendet wird, die nach einer 24- bis 48-stündigen Vorbereitungs- und einer nächtlichen Nüchternphase ermittelt werden. Nach Erfassung eines nüchternen Ausgangswerts (Basalwert), wird eine Lösung aus Lactulose – ein synthetischer, nicht-absorbierbarer Zucker – getrunken als Substrat für die bakterielle Fermentierung. Lactulose ist nicht absorbierbar, da nur Bakterien, aber nicht Menschen, Enzyme für dessen Verdauung produzieren. Lactulose ist eine Disaccharid-Lösung, bestehend aus Galaktose und Fructose in einer Basis, die auch winzige Mengen von Lactose und Epilactose enthält.69 Die Zeit, die Lactulose für die Passage durch den Magen und Dünndarm braucht, liegt bei etwa 120 Minuten. Glukose kann ebenfalls als Testlösung verwendet werden, aber aufgrund ihrer schnellen Absorption im oberen Bereich des Dünndarms, würde sie weiter abwärts gelegenes DDFB nicht aufzeigen.70 Während dieser Zeit, wird alle 20 Minuten eine Atemprobe genommen und auch noch eine dritte Stunde lang. Die Proben können dann sofort im Labor analysiert werden oder die Proben werden zuhause genommen, mittels einer Reihe an Teströhrchen für spätere Analyse. Heimtest-Atemproben werden in ein spezielles Reagenzröhrchen geblasen, ähnlich einem „Vacutainer“-Röhrchen, in denen die Proben aufbewahrt werden, bis sie ins Labor geliefert werden. Nicht alle Labore haben die Gerätschaften, um auf Methan zu testen und die Methodologie für Schwefelwasserstoff wird momentan noch perfektioniert und ist daher noch nicht erhältlich. Methantestung zusätzlich zur Wasserstofftestung ist wichtig, weil die Behandlung von der Art des Gases abhängt. Das unverwechselbare Symptom einer H2S-Produktion ist der Geruch von „faulen Eiern“ der Flatulenz oder beim Aufstoßen.
Die Vorbereitungen für den Test variieren von Labor zu Labor, aber eine typische Vorbereitungs-Diät ist limitiert auf weißen Reis, Fisch/Geflügel/Fleisch, Eier, Hartkäse, klare Rinder- oder Hühnerbrühe (keine Knochenbrühe oder Boullion), Öl, Salz und Pfeffer. Der Zweck der vorbereitenden Diät ist das Erhalten einer deutlichen Reaktion auf die Lactuloselösung indem gärfähige Nahrung am Tag vor dem Test vermieden wird. In Fällen von Verstopfung können sich zwei Tage der Vorbereitung anbieten, um den Basalwert der Gase auf Null zu bringen. Antibiotika sollten mindestens 2 Wochen vor dem ersten Test abgesetzt werden, obwohl manche Quellen 4 Wochen vorschlagen.71 Wenn die Symptome es zulassen, sollten auch Protonenpumpenhemmer mindestens 7 Tage vor dem Test abgesetzt werden.
Die Auswertung der Testergebnisse variiert von Arzt zu Arzt. Die von Quintron bereitgestellten Kriterien für ein positives Testergebnis sind folgende:
– Ein Anstieg der Wasserstoffproduktion auf 20ppm über den Basalwert oder höher innerhalb der ersten 120 Minuten nach Einnahme der Testlösung.
– Ein Anstieg der Methanproduktion auf 12ppm über den Basalwert oder höher innerhalb der ersten 120 Minuten nach Einnahme der Testlösung.
– Ein Anstieg in der Summe der Wasserstoff- und Methanproduktion auf 15ppm über den Basalwert oder höher innerhalb der ersten 120 Minuten nach Einnahme der Testlösung.
Weitere Test- und Auswertungsparameter
– Schwefelwasserstoff-DDFB kann vermutet werden, wenn die typischen Symptome anwesend sind, aber die Ergebnisse des Wasserstoff-Methan-Atemtests „Nullinie“ zeigen.73
– Werden, zu jedem beliebigen Testpunkt eines 3-stündigen Lactulose Atemtests geringe Methanwerte zu jeglichem Wert gleich oder größer als 3 ppm gemessen, kann das an methanbedingter Verstopfung liegen.74
– Ein „Punkt-Methanwert“ kann für die nachfolgende Testung bei methanpositiven Individuen festgelegt werden. Wenn nur auf Methan getestet wird, ist keine vorbereitendende Diät oder Nüchternheit für diese einzelne Atemprobe nötig.
RDS-Erkrankte, die erhöhte Methanwerte im Atem haben, leiden, in den meisten Fällen, an Verstopfung. Tierversuche an Mäusen ergaben, daß Methaninfusion die Passagezeit des Dünndarms verlängerte.75
Wir haben festgestellt, daß ein absoluter Gaswert, der nicht über den Basalwert ansteigt, mit klinischer DDFB einhergeht. Dies trifft besonders auf Methan zu, das ein Muster eines erhöhten Basalwerts aufweisen kann, der für die Dauer des Tests erhöht bleibt. In solchen Fällen steigt das Methan womöglich nur wenige ppm über den Basalwert, aber der Wert ist konstant im positiven Bereich. Die Auswertung erhöhter Wasserstoff- oder Methanwerte anhand von Basalwerten (Werte vor der Lactulose-Einnahme) ist umstritten, aber wir im SIBO Zentrum ziehen es vor, einen hohen Methan-Basalwert als positiven Test zu werten.76
Als klassisches Positiv bei DDFB wird ein zweimaliges Gipfeln der Werte angesehen, wobei der erste Höchstwert den Dünndarm repräsentiert und der zweite Höchstwert die normalen Dickdarmbakterien [dazu habe ich hier ein Testergebnis gefunden (bißchen runterscrollen), so kann das aussehen, Anm. der Übers.]. Der zweite Höchstwert ist nicht vonnöten, um ein akkurates Ergebnis zu haben. Unserer Ansicht nach ist auch ein einziger Höchstwert in der dritten Teststunde eine mögliche DDFB der unteren Dünndarmregion, derer die Werte des normalen Darmgases folgen.
Atemtests können auch bei Kindern angewandt werden, sofern das Kind den Anweisungen für die Atemprobe folgen kann. Kinder unter 3 Jahren werden am besten vor Ort in einem Labor getestet, aufgrund der unterschiedlichen Probeentnahme verglichen zu den Heim-Sets. Die Lactulose-Dosis für Kinder liegt bei 1g pro Kilo Körpergewicht mit einem Maximum von 10g (22 Pfund und darüber erhalten die Maximal- bzw. Erwachsenendosis von 10g).77 Lactulose ist nur auf Rezept erhältlich.
Behandlung von DDFB
2006 hat Dr. Pimentel seinen Behandlungsalgorithmus für DDFB veröffentlicht, der die Verwendung von Antibiotika, der Elementardiät oder beidem beinhaltete.78 Unsere Herangehensweise bietet zwei zusätzliche Möglichkeiten: Ernährung und pflanzliche Antibiotika.
Bild 4: DDFB Behandlungsprotokoll
(Die Graphik wird noch übersetzt und eingefügt!!)
Ernährung
Wir empfehlen die speziellen Ernährungsweisen der „Specific Carbohydrate Diet“ (SCD) oder „Gut and Psychology Syndrome Diet“ (GAPS) [„Spezifische/Spezielle Kohlenhydratdiät“ oder „Darm-und-Psyche-Syndrom“, Anm. d. Übers.].79, 80 Letztere (siehe www.siboinfo.com/diet.html bzw. hier) ist eine Kombination der „Specific Carbohydrate Diet“, der „low-FODMAP diet“ und der klinischen Erfahrungen von Dr. Siebecker und ihrer DDFB-Behandlung durch Ernährung. Bakterien nutzen Kohlenhydrate als ihre Energiequelle und vergären sie zu Gasen. Daher kann eine Ernährung mit wenig Kohlenhydraten („low-carb“) direkt die Symptome reduzieren, indem dadurch weniger Gasmengen produziert werden.81 Kohlenhydrate zu reduzieren kann auch die allgemeine mikrobielle Masse verringern, obwohl offizielle Studien, die das belegen, noch fehlen. Die „Specific Carbohydrate Diet“ und die „SIBO Specific Diet“ reduzieren gewaltig die Aufnahme von Polysacchariden, Oligosacchariden und Disacchariden indem sie alles an Getreide, stärkehaltigem Gemüse, Lactose und Süßungsmitteln (außer Honig und Dextrose) ausschließt. Hülsenfrüchte werden oft zu Beginn dieser Ernährungsumstellungen vermieden. Viele Patienten erfahren eine schnelle und signifikante Verbesserung ihrer Symptome nachdem sie eine DDFB-Ernährung anfangen. Von der „Specific Carbohydrate Diet“ wurde von einer Erfolgsrate von 84% bei chronisch-entzündlichen Darmerkrankungen berichtet, die oft in Zusammenhang mit DDFB stehen.82, 83 Patienten, denen die „Specific Carbohydrate Diet“ oder „SIBO Specific Diet“ zu einschränkend ist, können sich an die „Cedars-Sinai diet“ halten, die auf www.gidoctor.net/diet-ibs-sibo.php beschrieben wird [hier die Übersetzung].
Die „low-FODMAP diet“ ist ein Ernährungsplan, der erheblich die fermentierbare Menge an kohlenhydrathaltigen Nahrungsmitteln reduziert und eine Erfolgsrate von 76% bei RDS hat.84, 85 Die „low-FODMAP“ Ernährung ist nicht spezifisch für DDFB entworfen worden und eliminiert daher nicht Polysaccharid- und Disaccharid-Quellen wie Getreide, Stärke, stärkehaltiges Gemüse und Sucrose. Eliminierung dieser Poly- und Disaccharide ist bei DDFB hilfreich, weil diese Kohlenhydrate – die normalerweise den Wirt ernähren – auch die gesteigerte Anzahl der Mikroflora im Dünndarm ernähren (Bild 2).
Ernährung allein hat sich bei Säuglingen und kleinen Kindern erfolgreich erwiesen, aber ältere Kinder und Erwachsene brauchen oft eine oder mehrere Behandlungsmöglichkeiten um Bakterien schnellstens zu reduzieren, vor allem in solchen Fällen, in denen die Ernährung des Patienten bei dem Versuch, die Symptome zu verbessern, extrem eingeschränkt wird. Außerdem muß jede der oben erwähnten Ernährungsweisen durch systematisches Ausprobieren an das Individuum angepaßt werden.
„Low-carb“-Ernährungsweisen führen oft zu Gewichtsverlust. Besondere Aufmerksamkeit muß hier auf untergewichtete Patienten gelegt werden. Vermehrte Aufnahme von Winterkürbis, Glucose oder Honig kann unter solchen Umständen empfohlen werden. Weißer Reis (am besten Jasmin- oder Klebreis) oder helle Kartoffeln werden eventuell auch gebraucht, um das Gewicht zu halten, dazu ferner mittelkettige Triglycerid-Quellen wie Kokosöl oder andere Öle.
Ernährung ist auch grundlegend um Rückfälle nach erfolgreicher DDFB-Eradikation zu verhindern. Pimentel schlägt vor, mit Ernährungsumstellungen bis nach der erfolgreichen Behandlung der mikrobiellen Fehlbesiedlung abzuwarten, statt während der Behandlungsphase.86 Unsere klinischen Erfahrungen mit der „SIBO Specific Diet“ sind, daß sie für beides förderlich ist, die Behandlungs- und Präventionsphase.
Elementardiät
Anstatt Pharma- oder pflanzlicher Antibiotika, kann eine Elementardiät verwendet werden, um Bakterien rapide zu reduzieren. In der DDFB-Behandlung wird die Elementardiät angewandt, um alle anderen Nahrungsquellen auszuschließen. Diese Produkte sind ein Pulvermix aus freien Aminosäuren, Fett, Vitaminen, Mineralien sowie schnell absorbierbaren Kohlenhydraten. Das Konzept hinter der Behandlung ist, daß die Nährstoffe absorbiert werden, bevor sie den involvierten Organismus erreichen und daher den Patienten ernähren aber die Flora aushungern lassen. Es wird an Stelle aller Mahlzeiten verwendet, für zwei bis drei Wochen, und hat eine Erfolgsrate von 80 bis 85% beim Gebrauch des Nestlé Produkts Vivonex Plus.87 Zwei Versionen von Rezepten zum Selbstmachen einer Elementardiät gibt es bei www.siboinfo.com/elemental-formula.html. Elementardiäten sind keine Proteinshakes oder typische Detox-Pulver. Sie sind rezeptfrei zu erhalten und werden von den meisten Versicherungen nicht übernommen, was diese Behandlung recht teuer werden lassen kann. Patienten sollten gewarnt werden, daß Vivonex Plus oder hausgemachte Elementardiäten sehr bitter schmecken. Elementardiäten könnten ungeeignet sein für untergewichtige Patienten, die sich weiteren Gewichtsverlust nicht leisten können.
[Ich hab mal nach dem Vivonex-Zeugs geschaut und puh, ist wahrlich schweineteuer. Außerdem wird es von Nestlé produziert, die mit ganz oben auf meiner Boykott-Liste stehen, von demher würde ich denen das Geld nicht einmal in den Rachen werfen, wenn ich es hätte. Was ich auch komisch finde, sind die beiden erstgenannten Hauptbestandteile (unter „Ingredients“): Maltodextrin und Maisstärke, was beides absolut verboten ist laut der oben verlinkten Ernährungsliste (Soya auch, was ebenfalls enthalten ist), also versteh ich nicht wirklich, wie das Zeug ohne medikamentöse Begleitbehandlung sonderlich hilfreich bei der Viecherausrottung sein kann… Sollte es jemand von Euch ausprobieren, wäre ich sehr interessiert an einem Erfahrungsbericht!! Anm. der Übers.]
Pflanzliche Antibiotika
Während es nur zwei veröffentlichte Studien zu pflanzlichen Antibiotika bei der Behandlung von DDFB gibt, haben unsere Erfahrungen gezeigt, daß sie ähnliche Wirksamkeit wie Pharma-Antibiotika aufweisen.88,89 Chedid et. al. erforschten Patienten mit DDFB, die auf einem positiven Lactulose-Atemtest basierten. Ein negativer Atemtest ergab sich nach der Behandlung bei 34% der Rifaximin- oder dreifach-Antibiotika behandelten Gruppe, im Gegensatz zu 46% der pflanzlich behandelten Gruppe.
Die Studie bezog ein paar pflanzliche Mittel ein. Die Dosierung lag bei 2x täglich 2 Kapseln von jedem für 30 Tage lang. Die zwei unterschiedlich verpaarten Mittel sind in Tabelle 1 unten aufgelistet (FC-Cidal plus Dysbiocide oder Candibactin-AR plus Candibactin-BR):
Tabelle 1: Pflanzliche Zusammenstellungen für die Behandlung von bakterieller Fehlbesiedlung des Dünndarms (http://www.townsendletter.com/FebMarch2015/SIBOtable1.pdf)
| FC-Cidal | Dysbiocide | Candibactin-AR | Candibactin-BR |
| Eigenmischung, 500mg: 1 Kapsel
|
Eigenmischung, 950 mg pro 2 Kapseln
|
1 Kapsel á 408 mg enthält: | 1 Kapsel á 400 mg enthält:
Berberin HCl
|
[**Ich bin mir leider nicht sicher, in wieweit bei Berberis aquifolium ein Pflanzenextrakt gemeint ist oder das Homöopathische Mittel, sorry! Anm. der Übers.]
In unserem Zentrum haben wir die folgenden Pflanzen angewandt: Allium sativum (Knoblauch), Hydrastis canadensis (Kanadische Gelbwurz) und andere Berberin-haltige Kräuter, Origanum vulgare (Oregano) und Azadirachta indica (Neem/Niem). Wir haben diese als Einzelmittel und in verschiedenen Kombinationen ausprobiert, in Dosierungen, die als Höchstdosis auf dem Beipackzettel standen, 30 Tage lang. Spezifische Einzeldosen die wir anwandten, waren Allicin-Extrakt aus Knoblauch: 450mg 2-3x/Tag, Gelbwurz/Berberin: 5 g/Tag in aufgeteilten Dosierungen, emulgierter Oregano: 100 mg 2x/Tag und eine Formel die 300 mg Neem plus einer Eigenmischung, die insgesamt 200 mg der folgenden Pflanzen enthält: Emblica officinalis, Terminalia chebula, Terminalia belerica, Tinospora cordifolia, und Rubia cordifolia. Diese Mischung wird 3x/Tag eingenommen. Forscher der John Hopkins Universität haben andere Pflanzenmischungen erforscht, die in Tabelle 1 gelistet sind. Unsere Atemtestung hat die Notwendigkeit validiert, eine längere Behandlungsdauer von 30 Tagen anzusetzen, im Vergleich zu den 14 Tagen rezeptpflichtiger Antibiotika. Erwähnenswert ist, daß, obwohl ganzer Knoblauch ein „high-FODMAP“-Lebensmittel ist, wir noch nicht beobachten konnten, daß aufbereitetes Allicin in unseren Patienten Symptome hervorruft. Unseren Beobachtungen zufolge ist Allicin das einzige Kraut bisher, das Methanwerte bei Atemtests reduzieren kann. Wir haben auch beobachtet, daß manche Patienten bei pflanzlicher Behandlung anhaltende Absterbe-Reaktionen haben, die für die komplette Dauer der Behandlung anhalten können. Mehr Studien über pflanzliche Antibiotika zur DDFB-Behandlung sind vonnöten, vor allem um Pflanzenstoffe zu finden, die effektiv Methan reduzieren.
Antibiotika
Das am meisten erforschte und erfolgreichste verschreibungspflichtige Antibiotikum bei DDFB ist Rifaximin (Markenname Xifaxan). Es hat ein breites Wirkungsspektrum und ist nicht absorbierbar. Sein luminaler Status ermöglicht ihm, lokal zu wirken und es neigt daher weniger zu systemischen Nebenwirkungen, wie sie bei anderen Antibiotika üblich sind.90 Rifaximin hat eine Erfolgsrate von 91% und wird verabreicht zu 550 mg, 3x/Tag für 14 Tage. 91, 92 Viele Ärzte verschreiben weiterhin eine geringere Dosis von 1200 mg 2x/Tag für 10 Tage, obwohl Forschungen einen Anstieg von 22% in normalen Atemtestergebnissen bei der höheren Dosierung ergaben. Die empfohlene Dosierung bei Kindern liegt bei 200 mg 3x/Tag für 7 Tage für 3- bis 15-jährige, oder auch 10 bis 30 mg pro Kilo Körpergewicht.93, 94
Rifaximin hat einen zusätzlichen, einzigartigen Vorteil: angeblich verursacht es keine Hefepilz-Überbesiedlung und es verringert Antibiotikaresistenzen in Bakterien indem es Plasmide reduziert.95, 96 Gegenüber Rifaximin entwickelt sich keine Antibiotikaresistenz, was es für die Behandlung effektiv macht und es hat anti-entzündliche Eigenschaften, reduziert entzündliche Zytokine im Darm und blockiert NF-kb mittels PXR-Genen.97, 98 Rifaximin ist ein Einzel-Antibiotikum, das am besten bei DDFB angewandt wird, wenn nur die Wasserstoffwerte erhöht sind. Wenn Methan erhöht ist, ist eine Doppeltherapie mit Rifaximin und Neomycin (500 mg 2x/Tag für 14 Tage) effektiver.99 Viele Gastroenterologen verwenden Metronidazol (250 mg 3x/Tag für 14 Tage) als eine Alternative zu Neomycin (unveröffentlicht). Da verschiedene Antibiotika-Kuren aufgrund der Art von Gas verschrieben werden, ist Atemtestung unumgänglich wenn diese Behandlungsweise in Betracht gezogen wird.
Furnari et al. verglich den Prozentsatz von Atemtest-Normalisierung beim täglichen Gebrauch von 1200 mg Rifaximin im Vergleich zu 1200 mg täglich mit Zugabe von hydrolisiertem Guargummi (5 g täglich) für 10 Tage. Letztere, kombinierte Behandlung zeigte sich 23% effektiver als die alleinige Rifaximingabe.100
Wenn Schwefelwasserstoff-DDFB vermutet wird, sind die gleichen Behandlungsweisen wie bei methanogener Fehlbesiedlung erforderlich.
Aufbrechen des Biofilms
Mukosale methanogene Organismen können Biofilme bilden. 101 Der Gebrauch von Acetylcystein, Nattokinase, Serrapeptase oder Lumbrokinase kann in Betracht gezogen werden, zusätzlich zu pflanzlicher oder verschreibungspflichtiger Antibiotika-Behandlung, um schleimlösende Wirkung und Aufbrechen des Biofilms zu bewirken. Wie zuvor in diesem Artikel erwähnt, gibt es Beweise für als auch gegen einen Darmschleimhaut-Biofilm und DDFB.
(Seite 3)
Vorbeugung
DDFB ist eine Krankheit die wiederkommt, da die Eradikation an sich nicht immer die zugrundeliegenden Ursachen behebt.102, 103 Pimentels Behandlungsalgorithmus von 2006 beinhaltet zwei essentielle Vorbeugungsmethoden: Ernährung und ein Prokinetikum (ein Motilitäts-Wirkstoff). Unsere Herangehensweise bietet zusätzliche Optionen an: Salzsäure, Probiotika und Supplemente zur Heilung des Bürstensaums. Auch eine Überlegung wert sind körperliche Bewegung, Atemtechniken, Acetylcholin-Vorläufer und Modulatoren für Nervenentzündungen.
Eine zugrundeliegende Ursache für DDFB wird in der mangelhaften Aktivität des migrierenden motorischen Komplexes (MMC) angesehen. Nachts und in der Zeit zwischen den Nahrungsaufnahmen, bewegt ein intakter MMC Rückstände und Bakterien in den Dickdarm.104 Prokinetika stimulieren den MMC, wodurch sie symptomatisch die zugrundeliegende Ursache korrigieren. Iberogast ist eine deutsche Tinktur pflanzlicher Mischung, mit möglicher prokinetischer Wirkung.105 Diese Formel enthält alkoholische Extrakte aus Iberis amara totalis recens, Angelicae radix, Cardui mariae fructus, Chelidonii herba, Liquiritiae radix, Matricariae flos, Melissae folium, Carvi fructus und Menthae piperitae folium. Es wird seit den 1960er Jahren zur Behandlung von funktioneller Dyspepsie und RDS angewandt. Eine Studie belegte Symptomlinderung, aber keine Hinweise auf Beschleunigung der Darmentleerung, was suggeriert, daß wenn das Mittel prokinetisch wirkt, dies dann vermutlich nicht der einzige Wirkungsmechanismus ist, der seiner Wirkung bei RDS zugrunde liegt.106 Eine doppelt-blind Studie verglich Iberogast mit Cisaprid (ein verschreibungspflichtiges Prokinetikum mit begrenzter Sonderanwendung in Amerika aufgrund kardiovaskulärer Nebenwirkungen). Das pflanzliche Mittel schnitt genauso gut wie das prokinetische Medikament für funktionelle Dyspepsie ab und war sogar besser als Metoclopramid in einer retrospektiven Kohortenstudie mit 961 Patienten.107, 108 Es hat sich auch als wirksam bei RDS bei Kindern rausgestellt.109, 110
Verschreibungspflichtige Prokinetika die für DDFB erforscht wurden sind niedrig dosiertes Naltrexon 2,5 mg 1x täglich zur Schlafenszeit bei RDS mit Durchfall oder 2,5 mg 2x/Tag bei RDS mit Verstopfung. Ferner niedrig dosiertes Erythromycin 50mg täglich zur Schlafenszeit und 2-6 mg Tegaserod, ebenfalls täglich zur Schlafenszeit. 112, 111 Tegaserod hat eine höhere Erfolgsrate zur DDFB-Vorbeugung im Vergleich zu Erythromycin, wurde aber in den USA, aus Sicherheitsgründen, vom Markt genommen.113 Prucaloprid (Resolor), 0,5 bis 2 mg 1x täglich zur Schlafenszeit, was jedoch in den USA noch nicht verfügbar ist, allerdings eine sicherere Alternative zu Tegaserod darstellt. 61 Es ist momentan in Kanada und Europa erhältlich. Ein versuchsweises Absetzen des Prokinetikums nach etwa 3 Monaten wird geraten, aber fortgesetzte Langzeiteinnahme könnte bei manchen Patienten nötig sein.115
Ernährung
Eine low-carb Ernährung wird mit einem Prokinetikum kombiniert, um eine Rückkehr der bakteriellen Fehlbesiedlung zu verhindern. Wenn der Atemtest sich normalisiert hat und der Schaden im Dünndarm geheilt ist, kann die strenge Ernährung der „Specific Carbohydrate diet“ und „SIBO Specific diet“ etwas gelockert werden. Der Zeitrahmen dafür ist ungewiß. Zwei Studien haben sich mit der Heilrate nach der DDFB befaßt und herausgefunden, daß die Darmdurchlässigkeit sich innerhalb von 4 Wochen nach erfolgreicher DDFB-Eradikation in 75 bis 100% der Patienten normalisierte.116, 117 Während diese Berichte sehr ermutigend sind, können sie weitere benötigte Wiederherstellungen nach DDFB widerspiegeln, oder aber auch nicht. Daher empfehlen wir momentan, die DDFB-Diät ein bis drei Monate nach erfolgreicher Eradikation weiterzuführen. An diesem Punkt kann dann die „Cedars-Sinai diet“, die „low-FODMAP diet“ oder eine ähnliche Ernährungsweise für die langfristige Dauer angenommen werden, je nachdem, wie der Patient sie verträgt.118, 119 Diese Diäten erlauben Kohlenhydrate in Form von Getreide, glutenfreiem Getreide, Rohrzucker und Soja, begrenzen aber dennoch die allgemeine Kohlenhydratmenge.
Erlaubt man 4 bis 5 Stunden Abstand zwischen den Mahlzeiten, in denen nichts als Wasser zu sich genommen wird, ermöglicht man damit dem MMC stattzufinden.120 Wir haben das als klinisch sehr hilfreich festgestellt. Wenn eine low-carb DDFB-Ernährungsweise Hypoglykämie nicht verbessert, muß diese Strategie geändert werden, um eine häufigere Nahrungsaufnahme zu gewährleisten.
Nicht verbindliche Supplemente
Salzsäure oder pflanzliche Bitterstoff-Supplemente, die den Ausstoß von Salzsäure (HCl) anregen, können ebenfalls verwendet werden, um die Masse an anfallenden Bakterien zu reduzieren. 122 Zieht man HCl Supplementierung in Betracht, bietet sich der Test zur Messung der Magensäure nach Heidelberg an und ist die beste Methode. Testung nach Heidelberg erlaubt die Feststellung von Achlorhydrie, offener und verstecker Hypochloridie und ermöglicht dadurch eine individualisierte Dosierungsbemessung.
Probiotika sind ein kontroverser Eingriff bei DDFB, da Milchsäurebakterien bei DDFB fehlsiedeln können und es Bedenken gibt, zu dem bakteriellen „overload“ beizutragen. 122 Trotzdem haben die wenigen Studien, die sich direkt auf DDFB konzentriert haben, gute Ergebnisse aufgezeigt. Bacillus clausii als einzige Behandlung normalisierte den Atemtest in 47% der Fälle.123 Eine klinische Verbesserung von 82% der DDFB wurde durch eine Kombination von Lactobacillus casei und plantarum, Streptococcus faecalis und Bifidobacter brevis (Bioflora) erzielt.124 Probiotischer Joghurt, der Lactobacillus johnsonii enthält, normalisiert die Zytokin-Reaktionen, wodurch die chronische, leichte Entzündung, die bei DDFB vorkommt, nach 4 Wochen reduziert wird.125 Wir haben diverse mehr- und einzelstämmige Probiotika bei unseren Patienten angewandt, sowie Joghurt und durch Milchsäure vergorenes Gemüse, mit guten Resultaten. Der springende Punkt für die Anwendung von Probiotika-Supplementen bei DDFB ist, Präbiotika als Hauptinhaltsstoff zu vermeiden. Präbiotika sind fermentierbare Nahrung für Bakterien, die die Symptome während aktiver DDFB verstärken und das Bakterienwachstum nach der DDFB wieder begünstigen können. Gängige Präbiotika in Probiotika sind u.a. FOS (Fructooligosaccharide/Oligofructose), Inulin, Arabinogalactan, MOS (Mannose-Oligosaccharide) und GOS (Galactooligosaccharide/Oligosaccharide). Präbiotika können in kleinen Mengen als Grundbestandteil toleriert werden, aber das hängt vom Einzelnen ab.
Supplemente zur Heilung des Bürstensaums können zur unterstützenden Heilung des Dünndarmgewebes verabreicht werden. Während schleimbildende Kräuter traditionell zu diesem Zweck eingesetzt werden (Süßholz, Rotulme, Aloe Vera, Eibisch), ist ihre Verwendung zur Nachbehandlung von DDFB umstritten, aufgrund ihres hohen Gehalts an Mucopolysacchariden [Mehrfachzucker, die vor allem in Haut-, Knorpel- und Bindegewebe vorkommen, Anm. der Übers.], die fermentierbar sind und erneutes bakterielles Wachstum begünstigen könnten. Spezifische Nährstoffe, die wir verwendet haben, sind unter anderem lactosefreies Kolostrum (Erstmilch), 2-6 g täglich, L-Glutamin 375-1500 mg täglich, Zink-Carnosin 75 mg 2x täglich, Vitamin A und D, oft als Lebertran verabreicht, 1TL täglich,
Curcumin 400 mg-3g täglich, Resveratrol 250 mg-2 g täglich, Glutathion (oral liposomal) 50-425 mg täglich oder den Gluthathion-Vorgänger Acetylcystein 200-600 mg täglich. Supplemente werden für 1 bis 3 Monate verabreicht, obwohl sie, falls gewünscht, langfristig für das allgemeine Wohlbefinden angewandt werden können. Höhere Dosierungen von Curcumin und Resveratrol werden für zwei Wochen verabreicht, um NF-kb runterzuregulieren, ein Beschleuniger der erhöhten Darmdurchlässigkeit, welcher dann auf Normalzustand reduziert wird.126-128
Pflanzliche cholinerge Unterstützung können Lecithine, Pantothensäure, Huperzin A (aus Huperzia serrata) und Acetyl L-Carnitin (ALC) leisten.129 Pranayama (yogische abwechselnde Nasenlochatmung) hat sich als hilfreich bei RDS mit Durchfall gezeigt, um parasympathische Anspannung zu beruhigen.130
Wenn die Eindämmung einer Entzündung des zentralen Nervensystems angezeigt wird, kann man den Gebrauch von Catechinen in Betracht ziehen, enthalten in grünem Tee, Curcuma longa, Bioflavonoiden, Scutellaria (Helmkräuter), Resveratrol, Chrysanthemum morifolium Blättern und Matricaria chamomilla.131
In unseren Praxen haben wir festgestellt, daß die folgenden Bedingungen ein unbefriedigendes Resultat beim Patienten verstärkt:
– Scheitern beim (wiederholten) Durchführen der Behandlung, bis die DDFB beseitigt wurde (negativer Atemtest oder Besserfühlen des Patienten um ≥90%). Dieser ausschlaggebende Prozeß von fortlaufender Behandlung wird durch den langen Rückwärts-Pfeil auf der rechten Seite unseres Algorithmus dargestellt (Bild 4).
– Scheitern, zwei Antibiotika bei Methanproduzenten anzuwenden. Methanogene benötigen eine andere Antibiotika-Behandlung als wasserstoffproduzierende Bakterien.
– Scheitern, durch Atemtestung festzustellen, ob Patienten eine DDFB haben, welche Art von Gas sie produzieren und die allgemeine Menge an Gas. Diese Information ist für Diagnose, Behandlungswahl, Behandlungsdauer und Prognose notwendig.
– Scheitern der Anwendung eines Prokinetikums unmittelbar nach der Behandlung. Prokinetika werden, zusammen mit spezieller Ernährung, benötigt, um einen Rückfall dieser häufig wiederkehrenden Kondition zu verhindern. Antibiotika-Behandlung als einzige Therapie führt typischerweise zum Rückfall einer Wasserstoff-DDFB innerhalb von 3 Monaten und Methan-DDFB innerhalb eines Monats.127
– Scheitern der Einhaltung einer präventiven low-carb Ernährungsweise nach der Behandlung. Die spezielle Ernährung wird, zusammen mit Prokinetika, benötigt, um ein Wiederkehren dieser häufig wiederkehrenden Kondition zu verhindern.
– Scheitern im persönlichen Experimentieren und Anpassen der Ernährung auf individuelle Verträglichkeit. Keine feste, vorgegebene Ernährungsweise kann die komplexen bakteriellen, immunologischen, genetischen, Verdauungs- und Absorptions-Umstände jedes Einzelnen vorhersagen, weshalb individuelle Anpassung nötig ist.
– Scheitern bei der Identifikation der zugrundeliegenden, ursächlichen Bedingungen. Ein Bericht fand heraus, daß die folgenden Konditionen zu einer schlechten Reaktion auf die Antibiotika führten: anatomische Anomalien (Anhaftungen, das Syndrom der blinde Schlingen, Divertikulitis, das Wilkie-Syndrom (Arteria mesenterica superior Syndrom), usw.), chronischer Betäubungsmittelgebrauch, Nebennierenrindeninsuffizienz, Sklerodermie, Darmträgheit, chronisch-entzündliche Darmerkrankungen und NSAID-induzierte Geschwürbildung im Dünndarm.128 Einige dieser Patienten werden langfristig eine zyklische Rotation der pflanzlichen Behandlungen brauchen oder, sehr selten, eine 550 mg Einzeldosis Rifaximin jeden zweiten Tag, um symptomfrei zu bleiben.
– Scheitern beim Feststellen der zugrundeliegenden Ursachen, um den MMC zu reparieren oder zu regulieren, wird zu einem weniger erwünschten Ergebnis führen.
Fußnoten und Bibliographie
- Peralta S et al. Small intestine bacterial overgrowth and irritable bowel syndrome-related symptoms: experience with Rifaximin. World J Gastroenterol. 2009 Jun 7;15(21):2628–2631.
2. Lin HC, et al. Small intestinal bacterial overgrowth: a framework for understanding irritable bowel syndrome. JAMA. 2004 Aug 18;292(7):852–858.
3. Pyleris E et al. The prevalence of overgrowth by aerobic bacteria in the small intestine by small bowel culture: relationship with irritable bowel syndrome. Dig Dis Sci. 2012 May;57(5):1321–1329.
4. Pimentel M, Chow EJ, Lin HC. Normalization of lactulose breath testing correlates with symptom improvement in irritable bowel syndrome. A double-blind, randomized, placebo-controlled study. Am J Gastroenterol. 2003 Feb;98(2):412–419.
5. Anantharaju A Klamut M, Small intestinal bacterial overgrowth: a possible risk factor for metabolic bone disease. Nutr Rev. 2003 Apr;61(4):132–135.
6. Lauritano EC et al. Association between hypothyroidism and small intestinal bacterial overgrowth. J Clin Endocrinol Metab. 2007 Nov;92(11):4180–4184.
7. Almeida JA et al. Lactose malabsorption in the elderly: role of small intestinal bacterial overgrowth. Scand J Gastroenterol. 2008;43(2):146–154.
8. Kaur J, Prolonged orocecal transit time enhances serum bile acids through bacterial overgrowth, contributing factor to gallstone disease. J Clin Gastroenterol. 2014 Apr;48(4):365–369.
9. Klaus J et al. Small intestinal bacterial overgrowth mimicking acute flare as a pitfall in patients with Crohn’s Disease. BMC Gastroenterol. 2009 Jul 30;9:61.
10. Marie I, Ducrotté P, Denis P, Menard JF, Levesque H. Small intestinal bacterial overgrowth in systemic sclerosis. Rheumatology (Oxford). 2009 Oct;48(10):1314–1319. Epub 2009 Aug 20.
11. Rubio-Tapia A, et al. Prevalence of small intestine bacterial overgrowth diagnosed by quantitative culture of intestinal aspirate in celiac disease. J Clin Gastroenterol. 2009 Feb;43(2):157–161.
12. Mancilla A C et al. [Small intestine bacterial overgrowth in patients with chronic pancreatitis]. Rev Med Chil. 2008 Aug;136(8):976–980.
13. Tursi A, Assessment of small intestinal bacterial overgrowth in uncomplicated acute diverticulitis of the colon. World J Gastroenterol. 2005 May 14;11(18):2773–2776.
14. Ojetti V et al. Small bowel bacterial overgrowth and type 1 diabetes. Eur Rev Med Pharmacol Sci. 2009 Nov–Dec;13(6):419–423.
15. Goebel A et al. Altered intestinal permeability in patients with primary fibromyalgia and in patients with complex regional pain syndrome. Rheumatology (Oxford). 2008 Aug;47(8):1223–1227.
16. Gupta A et al. Role of small intestinal bacterial overgrowth and delayed gastrointestinal transit time in cirrhotic patients with minimal hepatic encephalopathy. J Hepatol. 2010 Nov;53(5):849–855.
17. Shanab AA et al. Small intestinal bacterial overgrowth in nonalcoholic steatohepatitis: association with toll-like receptor 4 expression and plasma levels of interleukin 8. Dig Dis Sci. 2011 May;56(5):1524–1534.
18. Weintock LB, Klutke CG, Lin HC, Small intestinal bacterial overgrowth in patients with interstitial cystitis and gastrointestinal symptoms. Dig Dis Sci. 2008 May;53(5):1246–1251.
19. Weinstock LB, Walters AS, Restless legs syndrome is associated with irritable bowel syndrome and small intestinal bacterial overgrowth. Sleep Med. 2011 Jun;12(6):610–613.
20. Parodi A et al. Small intestinal bacterial overgrowth in rosacea: clinical effectiveness of its eradication. Clin Gastroenterol Hepatol. 2008 Jul;6(7):759–764.
21. Kim KM,Erosive esophagitis may be related to small intestinal bacterial overgrowth. Scand J Gastroenterol. 2012 May;47(5):493–498.
22. Pimentel M. Personal communication. 2014
23. Husebye E. The patterns of small bowel motility: physiology and implications in organic disease and functional disorders. Neurogastroenterol Motil. 1999 Jun;11(3):141–161.
24. Bures J. 2010 Small intestinal bacterial overgrowth syndrome. World J Gastroenterol. 2010 Jun 28;16(24):2978–2990.
25. Machado WM et al. The small bowel flora in individuals with cecoileal reflux. Arq Gastroenterol. 2008 Jul–Sep;45(3):212–218.
26. Roland BC. Low ileocecal valve pressure is significantly associated with small intestinal bacterial overgrowth (SIBO). Dig Dis Sci. 2014 Jun;59(6):1269–1277.
27. Gabbard SL.The impact of alcohol consumption and cholecystectomy on small intestinal bacterial overgrowth. Dig Dis Sci. 2014 Mar;59(3):638–644.
28. Chedid V. Herbal therapy is equivalent to rifaximin for the treatment of small intestinal bacterial overgrowth. Glob Adv Health Med. 2014 May;3(3):16–24.
29. Macfarlane S. Microbial biofilm communities in the gastrointestinal tract. J Clin Gastroenterol. 2008 Sep;42 Suppl 3 Pt 1:S142–S143.
30. Gabbard SL.The impact of alcohol consumption and cholecystectomy on small intestinal bacterial overgrowth. Dig Dis Sci. 2014 Mar;59(3):638–644.
31. Pyleris E et al. The prevalence of overgrowth by aerobic bacteria in the small intestine by small bowel culture: relationship with irritable bowel syndrome. Dig Dis Sci. 2012 May;57(5):1321–1329.
32. Jacobs C. Dysmotility and proton pump inhibitor use are independent risk factors for small intestinal bacterial and/or fungal overgrowth. Aliment Pharmacol Ther. 2013 Jun;37(11):1103–1111.
33. Khoshini R, Dai SC, Lezcano S, Pimentel M. A systematic review of diagnostic tests for small intestinal bacterial overgrowth. Dig Dis Sci. 2008 Jun;53(6):1443–1454. - Pimentel M. Gut microbes and irritable bowel syndrome [webcast]. GastroIntestinal Health Foundation. July 20, 2012. http://www.gihealthfoundation.org/coe/ibs/webcast/2012/july/MPimentel/?link=2012/july
/MPimentel&cme_proj_id=12&actionPage=topics/Gut_Microbes_and_IBS/request-for-credit.cfm?cme_proj_id=12. Accessed on October 27, 2012.
35. Bouhnik Y et al. Bacterial populations contaminating the upper gut in patients with small intestinal bacterial overgrowth syndrome. Am J Gastroenterol. 1999 May;94(5):1327–1331.
36. Pyleris E et al. The prevalence of overgrowth by aerobic bacteria in the small intestine by small bowel culture: relationship with irritable bowel syndrome. Dig Dis Sci. 2012 May;57(5):1321–1329.
37. Carbonero F. Microbial pathways in colonic sulfur metabolism and links with health and disease. Front Physiol. 2012 Nov 28;3:448.
38. Million M. Correlation between body mass index and gut concentrations of Lactobacillus reuteri, Bifidobacterium animalis, Methanobrevibacter smithii and Escherichia coli. Int J Obes (Lond). 2013 Nov;37(11):1460–1466.
39. Medani M. Emerging role of hydrogen sulfide in colonic physiology and pathophysiology. Inflamm Bowel Dis. 2011 Jul;17(7):1620–1625
40. Elsheikh W. Enhanced chemopreventive effects of a hydrogen sulfide-releasing anti-inflammatory drug (ATB-346) in experimental colorectal cancer. Nitric Oxide. 2014 Sep 15;41:131–137.
41. Rodríguez LA. Ruigómez A. Increased risk of irritable bowel syndrome after bacterial gastroenteritis: cohort study. BMJ. 1999 Feb 27;318(7183):565–566.
42. Ibid.
43. Beatty JK. Post-infectious irritable bowel syndrome: mechanistic insights into chronic disturbances following enteric infection. World J Gastroenterol. 2014 Apr 14;20(14):3976–3985.
44. Zanini B. Incidence of post-infectious irritable bowel syndrome and functional intestinal disorders following a water-borne viral gastroenteritis outbreak. Am J Gastroenterol. 2012 Jun;107(6):891–899.
45. Hanevik K. Development of functional gastrointestinal disorders after Giardia lamblia infection. BMC Gastroenterol. 2009 Apr 21;9:27.
46. Pokkunuri V. Role of cytolethal distending toxin in altered stool form and bowel phenotypes in a rat model of post-infectious irritable bowel syndrome. J Neurogastroenterol Motil. 2012 Oct;18(4):434–442.
47. Pimentel M. Low-dose nocturnal tegaserod or erythromycin delays symptom recurrence after treatment of irritable bowel syndrome based on presumed bacterial overgrowth. Gastroenterol Hepatol (N Y). 2009 Jun;5(6):435–442.
48. Pokkunuri. Op cit.
49. Sung J et al Effect of repeated Campylobacter jejuni infection on gut flora and mucosal defense in a rat model of post infectious functional and microbial bowel changes. Neurogastroenterol Motil. 2013 Jun;25(6):529–537.
50. Pimentel M et al. Autoimmunity links vinculin to the pathophysiology of functional bowel changes following Campylobacter jejuni infection in a rat model. Dig Dis Sci. Epub 2014 Nov.
51. Kim G. Methanobrevibacter smithii is the predominant methanogen in patients with constipation-predominant IBS and methane on breath. Dig Dis Sci. 2012 Dec;57(12):3213–3218.
52. Dridi B. High prevalence of Methanobrevibacter smithii and Methanosphaera stadtmanae detected in the human gut using an improved DNA detection protocol. PLoS One. 2009 Sep 17;4(9):e7063.
53. Youn YH, Park JS, Jahng JH, et al. Relationships among the lactulose breath test, intestinal gas volume, and gastrointestinal symptoms in patients with irritable bowel syndrome. Dig Dis Sci. 2011 Jul;56(7):2059–2066.
54. Gottschall E. Breaking the Vicious Cycle: Intestinal Health Through Diet. Baltimore, ON: Kirkton Press Ltd.; 1994.
55. Elsenbruch S. Abdominal pain in Irritable Bowel Syndrome: a review of putative psychological, neural and neuro-immune mechanisms. Brain Behav Immun. 2011 Mar;25(3):386–394. Epub 2010 Nov 20.
56. Pimentel M. A New IBS Solution. Sherman Oaks, CA; Health Point Press; 2006.
57. Pimentel M, Mayer AG, Park S, Chow EJ, Hasan A, Kong Y. Methane production during lactulose breath test is associated with gastrointestinal disease presentation. Dig Dis Sci. 2003 Jan;48(1):86–92.
58. Kunkel D et al. Methane on breath testing is associated with constipation: a systematic review and meta-analysis. Dig Dis Sci. 2011 Jun;56(6):1612–1618.
59. Pimentel M, Lin HC, Enayati P, et al. Methane, a gas produced by enteric bacteria, slows intestinal transit and augments small intestinal contractile activity. Am J Physiol Gastrointest Liver Physiol. 2006 Jun;290(6):G1089–G1095.
60. Chatterjee S et al. The degree of breath methane production in IBS correlates with the severity of constipation. Am J Gastroenterol. 2007 Apr;102(4):837–841.
61. Pimentel M, Mayer AG, Park S, Chow EJ, Hasan A, Kong Y. Methane production during lactulose breath test is associated with gastrointestinal disease presentation. Dig Dis Sci. 2003 Jan;48(1):86–92.
62. Kim KM, Erosive esophagitis may be related to small intestinal bacterial overgrowth. Scand J Gastroenterol. 2012 May;47(5):493–498.
63. Singh VV, Toskes PP. Small bowel bacterial overgrowth: presentation, diagnosis, and treatment. Curr Treat Options Gastroenterol. 2004 Feb;7(1):19–28.
64. Leung Ki EL. Small intestine bacterial overgrowth. Rev Med Suisse. 2010 Jan 27;6(233):186–188,190–191.
65. DiBaise JK. Nutritional consequences of small intestinal bacterial overgrowth. Prac Gastroenterol. 2008;69:15–28.
66. Prizont R. Glycoprotein degradation in the blind loop syndrome: identification of glycosidases in jejunal contents. J Clin Invest. 1981 Feb;67(2):336–344.
67. Lauritano EC, Valenza V, Sparano L, et al. Small intestinal bacterial overgrowth and intestinal permeability. Scand J Gastroenterol. 2010 Sep;45(9):1131–1132.
68. Resnick C. Nutritional protocol for the treatment of intestinal permeability defects and related conditions. Nat Med J. March 2010.
69. Lactulose solution USP label. Pharmaceutical Assoc. Inc. Greenville, SC 29605.
70. Pimentel M. Report from the multinational irritable bowel syndrome initiative 2012. Gastroenterology. 2013 Jun;144(7):e1–e5.
71. Eisenmann A et al. Implementation and interpretation of hydrogen breath tests. J Breath Res. 2008 Dec;2(4):046002.
72. Costa MB. Evaluation of small intestine bacterial overgrowth in patients with functional dyspepsia through H2 breath test. Arq Gastroenterol. 2012 Dec;49(4):279–283.
73. Pimentel M. Lecture at the SIBO Symposium. Portland OR; 2014.
74. Ibid.
75. Attaluri A. Methanogenic flora is associated with altered colonic transit but not stool characteristics in constipation without IBS. Am J Gastroenterol. 2010 Jun;105(6):1407–1411.
76. Quigley EM, Quera R. Small intestinal bacterial overgrowth: roles of antibiotics, prebiotics, and probiotics. Gastroenterology. 2006 Feb;130(2 Suppl 1):S78–S90.
77. Quin Tron Instrument Company Inc.Quin Tron catalog and information. 2012:22.
78. Pimentel. New IBS Solution. 2006.
79. Gottschall. Breaking the Vicious Cycle. 1994.
80. Siebecker A. SIBO Specific Diet food guide. Available at http://www.siboinfo.com/uploads/5/4/8/4/5484269/sibo_specific_diet_food_guide_sept_2014.pdf.
81. Ong DK. Manipulation of dietary short chain carbohydrates alters the pattern of gas production and genesis of symptoms in irritable bowel syndrome. J Gastroenterol Hepatol. 2010 Aug;25(8):1366–1373.
82. Nieves R, Jackson RT. Specific carbohydrate diet in treatment of inflammatory bowel disease. Tenn Med. 2004 Sep;97(9):407.
83. Choung RS. Clinical predictors of small intestinal bacterial overgrowth by duodenal aspirate culture. Aliment Pharmacol Ther. 2011 May;33(9):1059–1067.
84. Shepherd SJ. The role of FODMAPs in irritable bowel syndrome. Curr Opin Clin Nutr Metab Care. 2014 Nov;17(6):605–609.
85. Staudacher HM, Whelan K, Irving PM, Lomer MC. Comparison of symptom response following advice for a diet low in fermentable carbohydrates (FODMAPs) versus standard dietary advice in patients with irritable bowel syndrome. J Hum Nutr Diet. 2011 Oct;24(5):487–495.
86. Pimentel M, Constantino T. A 14-day elemental diet is highly effective in normalizing the lactulose breath test. Dig Dis Sci. 2004 Jan;49(1):73–77.
87. Ibid.
88. Logan AC, Beaulne TM. The treatment of small intestinal bacterial overgrowth with enteric-coated peppermint oil: a case report. Altern Med Rev. 2002 Oct;7(5):410–417.
89. Chedid V. Herbal therapy is equivalent to rifaximin for the treatment of small intestinal bacterial overgrowth. Glob Adv Health Med. 2014 May;3(3):16–24.
90. Scarpignato C, Pelosini I. Experimental and clinical pharmacology of rifaximin, a gastrointestinal selective antibiotic. Digestion. 2006;73 Suppl 1:13–27.
91. Lombardo L, Increased Incidence of Small Intestinal Bacterial Overgrowth During Proton Pump Inhibitor Therapy. Clin Gastroenterol Hepatol. 2010 June; 8(6):504–508.
92. Pimentel M, Lembo A. TARGET Study Group. Rifaximin therapy for patients with irritable bowel syndrome without constipation. N Engl J Med. 2011 Jan 6;364(1):22–32.
93. Scarpellini E et al. Rifaximin treatment for small intestinal bacterial overgrowth in children with irritable bowel syndrome. Eur Rev Med Pharmacol Sci. 2013 May;17(10):1314–1320.
94. Muniyappa P et al. Use and safety of rifaximin in children with inflammatory bowel disease. J Pediatr Gastroenterol Nutr. 2009 Oct;49(4):400–404.
95. Scarpignato C. Pelosini I. Experimental and clinical pharmacology of rifaximin, a gastrointestinal selective antibiotic. Digestion. 2006;73 Suppl 1:13–27.
96. Debbia EA, Maioli E, Roveta S, Marchese A. Effects of rifaximin on bacterial virulence mechanisms at supra- and sub-inhibitory concentrations. J Chemother. 2008 Apr;20(2):186–194.
97. Yang J, Lee HR, Low K, Chatterjee S, Pimentel M. Rifaximin versus other antibiotics in the primary treatment and retreatment of bacterial overgrowth in IBS. Dig Dis Sci. 2008 Jan;53(1):169–174
98. Mencarelli A. Inhibition of NF-kB by a PXR-dependent pathway mediates counter-regulatory activities of rifaximin on innate immunity in intestinal epithelial cells. Eur J Pharmacol. 2011 Oct 1;668(1–2):317–324.
99. Low K, Hwang L, Hua J, Zhu A, Morales W, Pimentel M. A combination of rifaximin and neomycin is most effective in treating irritable bowel syndrome patients with methane on lactulose breath test. J Clin Gastroenterol. 2010 Sep;44(8):547–550.
100. Furnari M, Clinical trial: the combination of rifaximin with partially hydrolysed guar gum is more effective than rifaximin alone in eradicating small intestinal bacterial overgrowth. Aliment Pharmacol Ther. 2010 Oct;32(8):1000–1006.
101. Bang C. Biofilm formation of mucosa-associated methanoarchaeal strains. Front Microbiol. 2014 Jul 8;5:353.
102. Pimentel M, Morales W. Low-dose nocturnal tegaserod or erythromycin delays symptom recurrence after treatment of irritable bowel syndrome based on presumed bacterial overgrowth. Gastroenterol Hepatol (N Y). 2009 Jun;5(6):435–442.
103. Pimentel M. An evidence-based treatment algorithm for IBS based on a bacterial/SIBO hypothesis: Part 2. Am J Gastroenterol. 2010 Jun;105(6):1227–1230.
104. Pimentel M, Morales W. Low-dose nocturnal tegaserod or erythromycin delays symptom recurrence after treatment of irritable bowel syndrome based on presumed bacterial overgrowth. Gastroenterol Hepatol (N Y). 2009 Jun;5(6):435–442.
105. Ochoa-Cortes F. Potential for developing purinergic drugs for gastrointestinal diseases. Inflamm Bowel Dis. 2014 Jul;20(7):1259–1287.
106. Braden B. Clinical effects of STW 5 (Iberogast) are not based on acceleration of gastric emptying in patients with functional dyspepsia and gastroparesis. Neurogastroenterol Motil. 2009 Jun;21(6):632–638, e25.
107. Rösch W. A randomised clinical trial comparing the efficacy of a herbal preparation STW 5 with the prokinetic drug cisapride in patients with dysmotility type of functional dyspepsia. Z Gastroenterol. 2002 Jun;40(6):401–408.
108. Raedsch R. Assessment of the efficacy and safety of the phytopharmacon STW 5 versus metoclopramide in functional dyspepsia–a retrospective cohort study. Z Gastroenterol. 2007 Oct;45(10):1041–1048.
109. Leichtle K. Experience reports of the application of Iberogast in children. Research report. Steigerwald: Arzneimittelwerk; 1999.
110. Gundermann KJ, Vinson B, Hänicke S. Die funktionelle Dyspepsie bei Kindern – eine retrospektive Studie mit einem Phytopharmakon. Päd. 2004;10:1–6.
111. Ploesser J, Weinstock LB, Thomas E. Low dose naltrexone: side effects and efficacy in gastrointestinal disorders. Int J Pharm Compd. March 2010.
112. Pimentel M, Morales W. Low-dose nocturnal tegaserod or erythromycin delays symptom recurrence after treatment of irritable bowel syndrome based on presumed bacterial overgrowth. Gastroenterol Hepatol (N Y). 2009 Jun;5(6):435–442.
113. Pimentel M, Morales W. Low-dose nocturnal tegaserod or erythromycin delays symptom recurrence after treatment of irritable bowel syndrome based on presumed bacterial overgrowth. Gastroenterol Hepatol (N Y). 2009 Jun;5(6):435–442.
114. Manabe N, Rao AS, Wong BS, Camilleri M. Emerging pharmacologic therapies for irritable bowel syndrome. Curr Gastroenterol Rep. 2010 Oct;12(5):408–416.
115. Pimentel. New IBS Solution. 2006.
116. Lauritano EC. Small intestinal bacterial overgrowth and intestinal permeability. Scand J Gastroenterol. 2010 Sep;45(9):1131–1132. - Riordan SM et al. Luminal bacteria and small-intestinal permeability Scan J Gastroenterol. 1997 Jun;32(6):556–563.
118. Pimentel. New IBS Solution. 2006.
119. Gibson PR, Shepherd SJ. Evidence-based dietary management of functional gastrointestinal symptoms: The FODMAP approach. J Gastroenterol Hepatol. 2010 Feb;25(2):252–258. Review.
120. Pimentel. New IBS Solution. 2006.
121. Bowman G. The gut, the brain and the functional GI disorders. Functional Gastroenterology Seminar: Level 1. Winter 2010:19.
122. Bouhnik Y. Bacterial populations contaminating the upper gut in patients with small intestinal bacterial overgrowth syndrome. Am J Gastroenterol. 1999 May;94(5):1327–1331.
123. Gabrielli M. Bacillus clausii as a treatment of small intestinal bacterial overgrowth. Am J Gastroenterol. 2009 May;104(5):1327–1328.
124. Soifer LO, Peralta D, Dima G, Besasso H. Comparative clinical efficacy of a probiotic vs. an antibiotic in the treatment of patients with intestinal bacterial overgrowth and chronic abdominal functional distension: a pilot study. Acta Gastroenterol Latinoam. 2010 Dec;40(4):323–327.
125. Schiffrin EJ, Parlesak A, Bode C, et al. Probiotic yogurt in the elderly with intestinal bacterial overgrowth: endotoxaemia and innate immune functions. Br J Nutr. 2009 Apr;101(7):961–966.
126. Ruland J. Return to homeostasis: downregulation of NF-kB responses. Nat Immunol. 2011 Jun 19;12(8):709–714. doi:10.1038/ni.2055.
127. Al-Sadi RM, Ma TY. IL-1beta causes an increase in intestinal epithelial tight junction permeability. J Immunol. 2007 Apr 1;178(7):4641–4649.
128. Csaki C, Mobasheri A. Synergistic chondroprotective effects of curcumin and resveratrol in human articular chondrocytes: inhibition of IL-1beta-induced NF-kappaB-mediated inflammation and apoptosis. Arthritis Res Ther. 2009;11(6):R165.
129. Kharazian D. The Digestion Sessions [webinar series]. 2014.
130. Taneja I. Yogic versus conventional treatment in diarrhea-predominant irritable bowel syndrome: a randomized control study. Appl Psychophysiol Biofeedback. 2004 Mar;29(1):19–33.
131. Kharazian. Digestion Sessions. 2014.
Dr. Steven Sandberg-Lewis ist praktizierender Naturheilkundler der Gastroenterologie. Er praktiziert seit 36 Jahren, die ersten 18 Jahre in einer Privatpraxis. 1996 trat er, in Vollzeit, dem National College of Natural Medicine (NCNM) in Portland, Oregon bei. Vier Tage die Woche engagiert er sich in der Patientenbehandlung und ist ein Professor der Gastroenterologie. Er ist ein häufiger Präsentator bei Weiterbildungsseminaren in den USA und Kanada.
2013 wurde er unter den „Top Docs“ im Portland Magazine aufgeführt. Seine Artikel zur Hiatushernie und DDFB gewann den ersten Platz im Townsend Letter „Das Beste der naturheilkundlichen Medizin“ 2009 und 2013. Sein Beitrag zu Protonenpumpenhemmern wurde 2011 lobend erwähnt.
Als Mitbegründer des SIBO Center for Digestive Health (DDFB-Zentrum für Verdauungsgesundheit) im NCNM, behandelt Dr. Sandberg-Lewis oft Patienten, deren Gesundheitszustände keine Diagnose hergeben, trotz gründlicher medizinischer Untersuchung. Die Wiederherstellung optimaler Verdauungsfunktionen und die Normalisierung der Darm-Mikroflora brachten dem Zentrum einen erfolgreichen Ruf bei der Unterstützung vieler, die zuvor an Verdauungskrankheiten litten und keine Hoffnung auf Heilung hatten.
Sandberg-Lewis ist der Autor des Fachbuchs „Functional Gastroenterology: Assessing and Addressing the Causes of Functional GI Disorders“ (NCNM Press; 2009) („Funktionelle Gastroenterologie: Ursachen funktioneller gastrointestinaler Störungen beurteilen und ansprechen“). Zusammen mit seiner Frau und seinem Sohn, hat er ebenfalls eine DDFB- Erklärung als Comic für Patienten verfaßt. Beide Bücher sind unter www.ncnm.edu/bookstore erhältlich.
Allison Siebecker, Heilpraktikerin (ND), Praktizierende der TCM (MSOM) und lizenzierte Akupunkteurin (LAc), ist eine Absolventin des National College of Natural Medicine. Dr. Siebecker ist die Mitbegründerin und medizinische Direktorin des SIBO Center for Digestive Health an der NCNM Clinic in Portland, Oregon, wo sie sich auf die Behandlung von DDFB spezialisiert hat. Sie unterrichtet fortgeschrittene Gastroenterologie am NCNM, ist die Autorin der aufklärenden Webseite siboinfo.com und schreibt ein Buch, in dem sie sämtliches DDFB-Wissen gesammelt zusammenfaßt. 2005 und 2013 erhielt sie vom Townsend Letter den „Das Beste der naturheilkundlichen Medizin“-Preis für ihre Artikel „Traditionelle Knochenbrühe in moderner Gesundheit und Krankheit“ (2005) und „Bakterielle Dünndarmfehlbesiedlung: Oft übersehene Ursachen beim RDS“ (2013).
Pingback: Meine Darmgeschichte | ehrlich&offen
Pingback: Ernährung bei RDS und DDFB | ehrlich&offen
Pingback: DDFB-spezifische Diät: Ernährungsleitfaden | ehrlich&offen
Pingback: Gynäkologische Aspekte des RDS | ehrlich&offen
I was examining some of your content on this website and I think this web site is very informative ! Keep putting up.
LikeLike
Thank you!! 🙂
LikeLike
I cannot thank you enough for this information. After reading tons of material, you seem to sum up the current state of research. BUT… there seems to be an error.
QUOTE
1200mg 2x/Tag ist doch höher als 550mg 3x/Tag???? Oder ??
LikeLike
Hi Robert,
you’re very welcome!! But nope, no error, the original says the following:
„Rifaximin has up to a 91% success rate and is given at 550 mg t.i.d. × 14 days.(91,92) Many physicians continue to prescribe a lower dosage of 1200 mg b.i.d. × 10 days, although research shows a 22% increase in breath test normalization with the higher dosage.“
http://www.townsendletter.com/FebMarch2015/sibo0215_2.html
I was confused at first, too, but I figure it’s not so much about the amount per se, but rather about spreading it out over the whole day for two whole weeks instead of only ten days with two dosages that won’t do the work for 24 hrs. But I’m no doctor and only translated the text, so you’ll have to write to Dr. Sandberg-Lewis or Dr. Siebecker for a precise explanation. 😉
Best wishes,
Anja
LikeLike
I should have read the original first ;)…. damn my head is all wacky. Haven’t eaten in 7 days.
LikeLike
No problem, I know the feeling: it’s either a wacky head from not eating or a woozy head from eating… >.< But 7 days, wow, I'd go crazy from the stomach aches. O.o
LikeLike
Yea spreading out would be an idea 🙂
LikeLike
Kleiner Fehler
Letztere (siehe http://www.siboinfo.com/diet.html bzw. hier) ist eine Kombination der „Specific Carbohydrate Diet“, der „low-FODMAP diet“ und der klinischen Erfahrungen von D
Das Wort „hier“ ist ein Link das auf eine DE Domain zeigt die ins Leere führt
LikeLike
Hm, bei mir funktioniert’s, aber falls noch jemand Probleme hat, hier der Direktlink:
Klicke, um auf sibo_specific_diet_food_guide_sept_2014.pdf zuzugreifen
LikeLike
Das Allicin gibt es nur von Allimax oder? Hab jetzt auf amazon, medpex und zurrose nachgesehen. Allerdings enthält es Maltodextrose. Welches Präparat wäre denn zu empfehlen?
LikeLike
Hm, ich denke, es ist besser, wenn Du selbst ausprobierst, was für Dich am besten ist. Ich hab alle möglichen Präparate durchprobiert, von billige(re)n „no-name“-Knoblauchprodukten (mit und ohne Füllstoffen) bis hin zu den teuren Allimax und Allimed Produkten, aber ich konnte bei nichts davon eine wirklich herausragende Wirkung spüren… Vllt. bringen Allimax/Allimed in extrem hohen Dosierungen Abhilfe, aber konnte ich wg. dem hohen Preis nie ausprobieren.
Damit will ich Dir keinesfalls die Hoffnung nehmen, nur weil das bei mir nicht richtig funktioniert hat, heißt es nicht, daß es das bei Dir auch tut, also bitte nicht von mir entmutigen lassen!!
LikeLike
vielen lieben Dank für den Text aus dem townsend Letter.
LikeLike
Liebe Anja,
hat dir inzwischen irgendetwas bei der DDFB geholfen, oder ist alles nach wie vor?
LikeLike
Hallo liebe Salina,
nein, es hat nichts wirklich geholfen und nachdem mir dieses Jahr unzählige Zahnbehandlungen in die Quere kamen, konnte ich es mir noch weniger als vorher leisten, noch irgendwas dagegen zu unternehmen. Sollte ich es irgendwann schaffen, irgendwie nochmal Geld zu verdienen, geh ich das Ganze nochmal an, bis dahin ist es halt, wie es ist. ;/
Liebe Grüße,
Anja
LikeLike
Hallo zusammen,
Hat irgend jemand Erfahrung mit Candibactin AR & BR ?
Lg
LikeLike